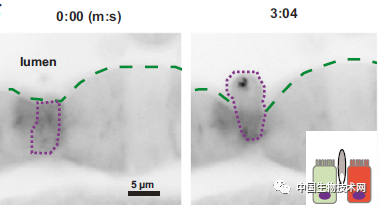
斑马鱼肠上皮细胞会互相挤压,并在10分钟内将被标记为“破坏”的细胞排出。图片来源:John Rawls Lab, Duke University
8月7日发表在《美国国家科学院院刊(PNAS)》上的一项研究,来自美国杜克大学的研究团队发现,斑马鱼肠道内的细胞(可能也包括人类)在面对某些毒素时会使用一种不同寻常的防御机制—— “按下弹出键”,排出有害物质。
杜克大学的研究生Ted Espenschied说:“肠道的工作非常具有挑战性,它需要处理我们摄入或产生的各种化学物质,而其中有些是具有破坏性的。因此,它已经进化出许多抵御这些破坏作用的有趣方法。”这项研究是Espenschied毕业论文的一部分。
该研究团队测试了超过20种非甾体抗炎药(NSAID),试图将斑马鱼作为研究肠道化学损伤的新模型。这种鱼的饲养成本很低且易于繁殖,最重要的是,它们在生命早期是半透明的,很容易通过罐水进行化学品接触和测量其环境条件。
在这项研究中,研究人员发现了一些意外事件。
杜克大学微生物中心主任、分子遗传学和微生物学助理教授John Rawls说:“通常情况下,药物会产生多种脱靶效应。”
但在他们测试的药物中,似乎只有一种名为Glafenine的非甾体抗炎药给斑马鱼带来了可测量的差异。三十年来,它一直是欧洲和中东地区使用的一种非处方口服止痛药,但在发现与肾脏和肝脏损伤有关后被下架。
Glafenine通过一种叫做“剥离(delamination)”的过程使斑马鱼在一夜之间脱落了多达四分之一的肠上皮细胞。研究人员在过去没有意识到,剥离看起来是灾难性的,但实际上是一种高效的防御策略。
肠道内壁是一层紧密排列的指状上皮细胞。 当肠上皮细胞受到损伤时,它会以某种方式被标记为“破坏”。 在“剥离”过程中,邻近的上皮细胞推动注定要死亡的细胞,以放松其锚定的基底膜。 相邻的细胞不断涌进推挤受损细胞,最终使其“弹出”到肠道中,走上死亡之路。
斑马鱼肠的横截面显示绿色上皮细胞和粉红色吸收细胞表达的蛋白质之间的连接图片来源:John Rawls Lab, Duke Universitya
Espenschied非常关注这项意外的发现,他说:“我们没有料到‘剥离’过程具有保护作用。只有一种NSAID具有这种导致肠上皮剥离的惊人作用,我们还在绞尽脑汁地研究它。”
Rawls补充说:“因此我们进行了追踪研究。”
经过多次实验并对Glafenine的化学特性进行详细分析后,Espenscheid确定,对肠道有害的并不是非甾体抗炎药的性质,而是它抑制一种细胞结构的能力,这种结构被称为多重耐药性(MDR)外排泵,这在非甾体抗炎药中显然是独一无二的。
这些外排泵的存在有助于从细胞内部清除有害的化学物质。癌症研究人员一直有兴趣寻找阻断MDR外排泵的方法,因为肿瘤利用这些外排泵将化疗药物排出癌细胞,阻碍了癌症治疗。
Rawls说:“对于它在正常细胞中的作用所知甚少。但我们确实知道,如果你阻止它们,细胞就无法清除有毒物质,问题也会就随之而来。当Glafenine阻断了斑马鱼的MDR外排泵,肠道就会发生‘剥离’过程,但研究人员还没能确定这一机制。”
Espenschied说:“我们还不清楚哪些细胞会被剥离,及其被剥离的原因。这些细胞与相邻细胞之间的差异是个有趣的问题,目前我们还无法解答。”
Rawls说:“‘剥离’是应对多种不同攻击的共同解决方案。但要弄清楚它是否会导致损伤和疾病,或者是否是为了应对损伤而产生的有益适应,这一直是一项挑战。我们的研究表明,这一过程实际上是有益的。”
来源:中国生物技术网 2019-08-08





