一、免疫疗法成功的三大基石
以免疫检查点抑制剂为代表的肿瘤免疫疗法在临床上取得的成功大伙有目共睹,但归根到底还只是小部分人获益。究竟是什么原因,说到底,还是我们对肿瘤免疫的认知甚少,存在大量的黑匣子。
《NatureReviewsCancer》曾有篇综述分析了一些成功免疫疗法(包括过继性细胞疗法和肿瘤疫苗)的共性,成功需要以下三个基础条件:
合适肿瘤抗原的选择:
目前临床上针对肿瘤治疗开展的抗原主要分为四类
a) 高表达的正常抗原:正常组织低表达,而肿瘤组织高表达,如黑色素瘤高表达的Tyrosinase,TRP-1,TRP-2等等。
b) 分化抗原:在早期发育中曾经出现,但发育成熟后消失的抗原,如NY-ESO-1,MAGEs,MUC-1,CEA,AFP,CA-125。
c) 病毒导致的导致肿瘤蛋白:在病毒诱导的癌症类型中,抗原也应该来自病毒,如宫颈癌E4、E5蛋白。
d) Neoantigen(新生抗原):主要是肿瘤细胞基因突变或重排产生的异常蛋白,而不存在于正常的组织与器官中。
理想的肿瘤抗原的选择自然是肿瘤细胞特有的,正常组织没有,同时抗原具有足够强的免疫原性。
目前的CD19属于正常B细胞抗原而不是肿瘤特异性抗原。因此CD19-CAR-T治疗是以牺牲正常B细胞为基础发展以来的。开发针对HER-2、EGFR等的CAR-T因为正常组织也表达,因此临床的副作用很大而被迫停止。
肿瘤新生抗原似乎解决了符合理想的新生抗原的靶标的选择,临床上也有些针对新生抗原的治疗成功的个例,但概念性的验证试验还有待时间去验证。
产生足够量的效应/杀伤性T细胞以及存活足够长的时间
肿瘤细胞和效应T细胞的博弈不光是杀伤能力的PK,同样也要看数量上的比拼。因此通常过继性的细胞疗法对于一定体积的晚期实体瘤,只有达到一定数量的T细胞回输才能够有明显的效果。
除此之外,效应T细胞存活的时间也跟肿瘤治疗的效果有很大的关系。从现有的研究来看,通常提高过继性回输的免疫细胞中记忆性细胞亚群的比例,是维持持久免疫应答的重要措施之一,细胞培养过程中加入IL-12、IL-15,或提供T细胞活化的共刺激信号CD27、4-1BB等均可不同程度提高记忆细胞亚群的比例,增强免疫细胞活力。
克服肿瘤微环境与免疫逃逸
如果把肿瘤细胞比作是一个个坏蛋分子,那么从整体上看,实体瘤就是个黑社会组织,这个组织首先打造自身的铜墙铁壁,把警察抵抗在门外,同时也会收买、饿死、改造混入其中的警察。
这个组织不断的通过微环境来胁迫他人,获得自己发展所需的资源。原本微环境其实是遏制肿瘤细胞生长保护正常细胞存活的地方,但是随着肿瘤的生长发展,正常的环境被肿瘤细胞不断的破坏,环境开始被慢慢的改造成适合肿瘤细胞所生活的场所,而正常细胞就逐渐被驱逐出来。
除了精心打造了这个组织体系外,肿瘤细胞还练就了其他的逃逸机制包括:降低肿瘤细胞的抗原呈递、形成肿瘤免疫抑制性微环境,对浸润的淋巴细胞进行耗竭,表达“别吃我”信号,等产生免疫抑制。
之前,人们对于肿瘤的治疗一般将思路局限于肿瘤细胞本身,利用抗肿瘤药物和靶向制剂对肿瘤细胞进行杀伤。然而,近年来越来越多的科学家开始将治疗策略逐步关注到肿瘤微环境上,旨在调控肿瘤细胞的土壤环境,同时辅以肿瘤微环境的改造,形成肿瘤深入治疗的新策略。
二、肿瘤微环境中的“四大金刚”
那闲扯了这么多,究竟什么是肿瘤的微环境呢?微环境里究竟又有些啥呢?
肿瘤微环境(tumormicroenvironment,TME)是由肿瘤细胞、常驻和招募的宿主细胞(分别与癌症相关的成纤维细胞和免疫细胞)、以及上述细胞的分泌产物(如细胞因子和趋化因子)和细胞外基质(ECM)中的非细胞成分组成。
在肿瘤微环境里面有一些相当正义的细胞——淋巴细胞,他们是攻击癌症的主力军,由T细胞、B细胞和自然杀伤性细胞(NK细胞),我们又管这些细胞叫做肿瘤浸润淋巴细胞(简称TILs),就是笔者上篇写的《TIL对战实体瘤,锋芒初露?》的男主角。但科学家们发现处于肿瘤微环境中的TILs的抗肿瘤活性远远低于远离肿瘤周围的其他淋巴细胞。到底是什么原因导致了这样的差异呢?在之后的研究中,人们揪出了元凶——肿瘤微环境(TME),TME不仅会让周围的细胞产生免疫抑制,同时还会帮助肿瘤细胞逃避免疫攻击。
Dangdangdang,~我们今天的主角终于上场了——肿瘤免疫抑制性微环境,他主要是由肿瘤细胞产生的免疫抑制分子、基质成分和抑制性的免疫细胞和相关免疫抑制性细胞因子构成。
其中免疫抑制性细胞主要由肿瘤微环境抑制性“四大金刚”组成,分别为:肿瘤相关巨噬细胞、调节性T细胞、骨髓来源的抑制性细胞、肿瘤相关成纤维细胞。而免疫细胞因子主要包括IL-10,TGF-β,此外还有PD-1/PD-L1等免疫检查点分子及外泌体等。
下图回顾了肿瘤微环境的发展历程中的一些里程碑事件,从最初的“种子与土壤”学说到免疫检查点抑制剂的大获成功。
尽管目前PD-1和CAR-T会带来长期的生存获益,但获益群体有限,科学家们把目光纷纷转向了针对肿瘤微环境来开发药物。在介绍研发策略之前,还是让我们更深入的了解这“四大金刚”。
★ 首先介绍的是“四大金刚”中的肿瘤相关巨噬细胞(TAMs),因为这位大佬是肿瘤间质最主要的免疫细胞,有时肿瘤组织中巨噬细胞的比例大于50%。按照表型和功能不同巨噬细胞可分为M1型和M2型,M1型(忠良型)能够杀伤、抑制细胞生长和分泌炎性细胞因子,有利于刺激天然T细胞产生Th1型反应;M2型(奸恶型)有利于刺激天然T细胞产生Th2型反应,能够分泌VEGF、EGF、TGF-β等细胞因子,促进修复和抑制免疫反应。由于肿瘤微环境中存在的前列腺素E2和TGF-β以及缺乏TOLL受体(Toll-likereceptor,TLR)的活化、TAM主要表现为M2型巨噬细胞表型,其对肿瘤的发生、发展及转移具有促进作用。
★ 调节性T细胞(Regulatorycells,简称Tregs),是非常让人头大的一类细胞,可抑制T细胞免疫以及疫苗活化。比如Treg诱导APC表达B7-H4,而B7-H4+APC会抑制T细胞的增殖周期;活化的Treg细胞释放穿孔素或粒酶直接杀伤T细胞和AFC;Treg在体内释放IL-10和TGF-β等细胞因子,通过抑制MHC分子、CD80、CD86等分子表达,抑制IL-12分泌,直接抑制T细胞活化。
★ 髓源性抑制细胞(MDSC),是一类异质细胞群体,来源于骨髓祖细胞和未成熟的骨髓细胞(immaturemyeloidcell,IMC)。在肿瘤中IMCs受细胞因子的作用无法正常分化成为成熟的骨髓细胞,从而形成具有免疫抑制功能的MDSCs。其介导的免疫抑制主要通过两种机制:一种是对肿瘤微环境内营养物质的消耗,即通过表达Arg1、IDO1、诱导型一氧化氮合酶等方式消耗细胞外基质中的必需氨基酸从而阻碍免疫细胞的增殖;第二种是造成肿瘤微环境内的氧化应激,即通过iNOS和NADPH氧化酶(NOX2)生成一氧化氮(NO)和活性氧ROS从而对免疫细胞的活性产生影响。
★ 肿瘤相关成纤维细胞(CAFs),作为肿瘤微环境的主要基质细胞,TAFs主要分布于肿瘤侵袭的前沿或肿瘤血管内皮细胞的周围。其作用机制主要包括:(a)TAFs可与其临近的肿瘤细胞直接接触,促使肿瘤自原发部位向远端进行转移。(b)旁分泌途径:TAFs可以分泌多重可溶性的细胞因子,主要包括CXCL12、TGF-β、HGF,进而促进肿瘤细胞的增殖和转移。(c)免疫调控途径:TAFs通过抑制免疫细胞的募集及分泌免疫抑制相关因子从而促进肿瘤逃避的免疫应答(d)胞外基质(ECM)重塑途径:TAFs通过分泌各种基质酶,如基质金属蛋白酶(MMP)或成纤维细胞活化蛋白(FAP等,主要参与ECM的重建和产生致密的胞外基质,从而阻止淋巴细胞的浸润。
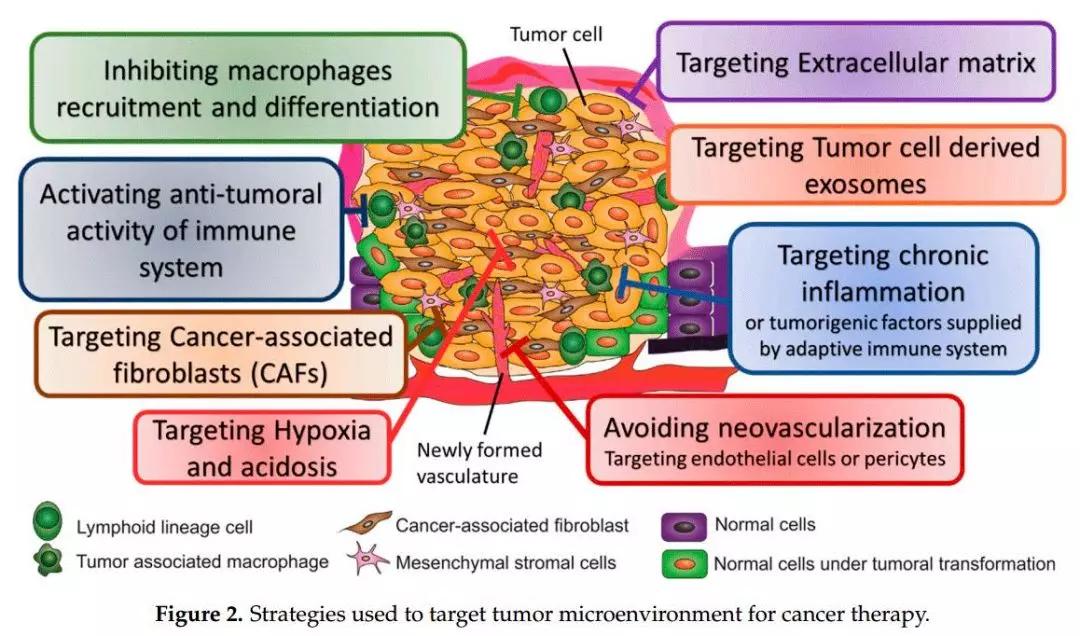
三、靶向肿瘤微环境的治疗策略
以上谈的是肿瘤微环境的生理学基础结构和功能,由此开展出针对靶向这些微环境的治疗策略,笔者作出以下的分类和汇总:
(一)靶向胞外基质
(二)针对缺氧和酸中毒条件
(三)靶向新生血管
(四)靶向肿瘤微环境免疫系统
a)抑制巨噬细胞的招募和分化
b)靶向炎症因子
c)激活免疫系统的抗肿瘤活性
(五)针对癌症相关成纤维细胞
四、下一代肿瘤免疫疗法,小分子能否引领浪潮?
与免疫检查点抑制剂和CAR-T细胞的临床进展平行,一系列基于小分子的免疫疗法从最初的发现到临床试验阶段行进中,其中包括能够靶向免疫抑制机制或激活先天和/或适应性免疫途径的化合物。
相对于生物药,小分子的优点包括:
√ 良好的口服依从性
√ 可以靶向受体或参与细胞内信号转导的酶
√ 对肿瘤微环境的更大渗透性,以及穿过细胞膜进入细胞内靶标的能力;
√ 更容易精确控制其生物利用度:避免一些与基于抗体和细胞的生物疗法相关的免疫相关不良事件;
√ 生产和管理成本较低
下图概览了部分靶向肿瘤微环境的小分子作用机理:
总结了临床在研的靶向肿瘤微环境的小分子进展:
五、全文总结
在肿瘤微环境这条路上,既有成功的VEGF,也有出师未捷的IDO,崭露头角的TGF-β和STING,和正在摸索的A2A。
尽管仍存在大量的未知和风险,但在PD-1带来的超长生存期的鼓舞下,大量的人力和财力会集中到这个方向上,一起探索。
“Now this is not the end. It is not even the beginning of the end. But it is, perhaps, the end of the beginning.”—— 温斯顿•丘吉尔