摘要
姜黄素是一种天然的多酚类化合物,广泛存在于包括姜黄在内的多种草本植物中。
它是一种天然的抗氧剂,具有许多的药理活性,安全有效,尤其是抗肿瘤作用受到广泛的关注。
但由于姜黄素的水中溶解度差、光降解、化学不稳定以及生物利用度低等问题限制了其在临床的广泛应用。
因此,需要开发适当的给药系统来解决这一问题。
本文综述了近年来姜黄素纳米制剂在肿瘤治疗中的研究进展,重点阐述了其抗肿瘤纳米制剂的种类及其在细胞和动物实验中的应用,为进一步的研发提供依据。
关键词
姜黄素;抗肿瘤;生物利用度;纳米制剂
正文 |
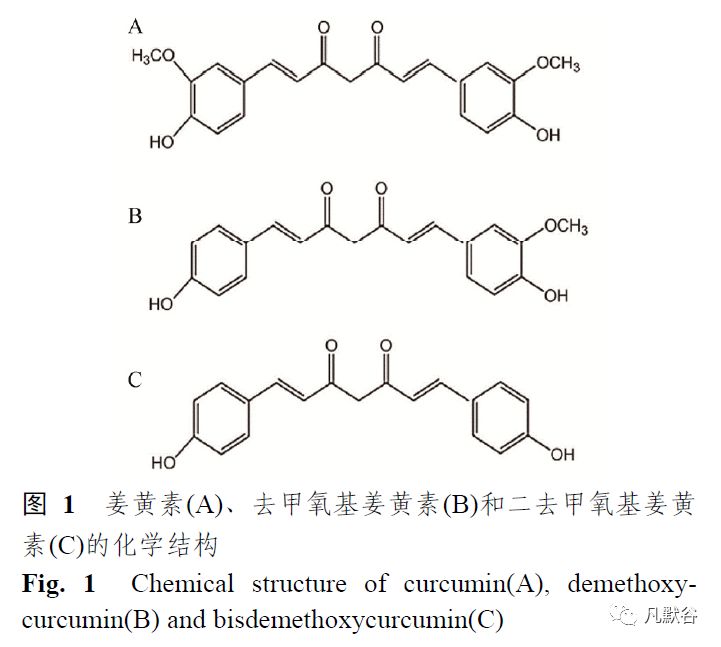
姜黄素(curcumin,CUR)是从姜科姜黄属姜黄、郁金、莪术等植物根茎中提取出的一种植物多酚化合物[1]。
它在自然界中包含多种不同的化学结构,主要是由CUR(77%)、去甲氧基姜黄素(17%)和二去甲氧基姜黄素(6%)组成[2-3](图1),其中CUR是最主要的活性成分。
研究表明,CUR 具有抗肿瘤[4-5]、抗炎[6]、抗氧化[7]、抗纤维化[8]等药理作用,非常具有开发前景。
近年来,CUR 的抗肿瘤作用备受药学工作者的关注,被建议用作各种癌症的预防和治疗,如胃肠道癌、黑色素瘤、泌尿生殖系统癌症、肺癌等。
在分子水平上,CUR 不但有效地抑制细胞增殖和转移,而且通过调节多种炎症因子、肿瘤坏死因子、干扰素、转录因子、生长因子、蛋白激酶等诱导细胞凋亡[9-10]。
但CUR难溶于水,且生物利用度低,从而限制了其制剂的开发和应用[11]。
近年来,CUR 新型载体给药系统的研发为其临床应用开辟了广阔的前景。
现就近年来国内外CUR 抗肿瘤新型纳米制剂的种类、细胞学和动物实验进行综述,为其研发与应用提供依据。
1
CUR 抗肿瘤新型纳米制剂的种类
1.1 脂质体
脂质体是将药物包封于类脂质双分子层内而形成的微型泡囊体,具有低毒、细胞亲和性及靶向性等特点,亲水性和亲脂性药物均可被包载到脂质体中[12-13]。
目前脂质体在抗肿瘤药物的制备中取得了较好的应用,成功上市的品种有紫杉醇脂质体、多柔比星脂质体、柔红霉素脂质体、顺铂脂质体以及环孢素A 脂质体等。
由于CUR 是一种水溶性差的药物,脂质体已被用作药物递送系统来提高CUR 的治疗效果和安全性。
采用聚乙二醇(PEG)覆盖在脂质体外层制备的聚乙二醇化长循环脂质体,由于其表面亲水性增加,并且存在空间位阻,可以有效地避免药物被网状内皮系统识别,从而延长药物的体内滞留时间。
Lin 等[14]采用薄膜水化法以脂质-聚乙二醇-聚乙烯亚胺复合物(Lipo-PEG-PEI-complex,LPPC)为载体材料,成功制备了CUR 阳离子脂质体(Curcumin/LPPC)。
该法制备的Curcumin/LPPC 粒径范围为258~269 nm,包封率为(45±0.2)%。
体外释放结果表明,CUR 在脂质体中可以满足缓释释放,120 h 释放度达到90%。
此外,相比于游离CUR,Curcumin/LPPC 对CUR 敏感细胞和CUR抵抗细胞均具有更高的细胞毒性,可能是由于阳离子脂质体促进了CUR 内化进入肿瘤细胞。
因此,长循环脂质体可以克服CUR 体内的快速消除效应,从而提高其体内生物利用度。
为了提高脂质体抗肿瘤的靶向性,Zhao 等[15]制备了具有主动靶向功能的狂犬病毒糖蛋白的衍生肽(RVG-derived peptide,RDP)修饰的载CUR 脂质体(curcumin-loaded RDP-liposome,RCL)。通过乙酰胆碱受体介导的内吞作用,该脂质体显著提高了CUR 在脑胶质瘤细胞的摄取量。
此外,在小鼠脑胶质瘤动物模型中,RCL 使荷瘤小鼠的存活时间从23 d 延长到33 d。
早期的传统脂质体只是简单地利用磷脂和胆固醇为膜材料,将药物包载于脂质双分子层形成的薄膜中间,靶向作用不明显。
近年来,药学工作者通过对其组成和表面结构进行修饰,制备了各种新型脂质体,如pH 敏感脂质体、热敏感脂质体、受体靶向脂质体和磁靶向脂质体等。
因此,新型脂质体的出现为CUR 纳米脂质体的制备提供了新思路。
1.2 固体脂质纳米粒(solid lipid nanoparticles,SLN)
SLN 是以固态天然或合成的类脂为载体,将药物包裹或夹嵌于类脂核中制成的固体胶粒给药系统[16],其粒径通常在50~1 000 nm。
SLN 具有低毒、生物相容性好、生物可降解、控制药物释放、避免药物的降解或泄漏以及靶向性良好等优点[17-18],从而成为新一代纳米粒给药系统。
Ramalingam 等[19]采用熔融-乳化法制备了N-三甲基壳聚糖(TMC)涂覆的CUR 固体脂质纳米粒(curcumin-loaded solid lipid nanoparticles,SLCNs)。
首先,将棕榈酸和胆固醇加热熔融后加入CUR分散均匀,然后加入事先预热的维生素E 聚乙二醇琥珀酸酯(TPGS)水溶液,11 000 r·min下均质5 min。
将所得的初乳超声处理后冻干。通过将带负电的SLCNs 与带正电的TMC 在水中搅拌10 h , 离心处理后即得到表面修饰的SLCNs(TMC-SLCNs)。
与未修饰的SLCNs(138.8±7.6)nm,(29.67±1.20)mV 相比,TMC-SLCNs 的粒径由于TMC 的包覆作用显著增大[(412±79.7)nm],同时表面电荷反转[(35±1.03)mV]。
口服生物利用度研究证实TMC-SLCNS 具有较高的药时曲线下面积(AUC)和更长的血浆半衰期(t1/2),同时增强了脑分布。
这表明SLN 可以保护药物不被胃肠道系统中酶降解,增加了药物稳定性,并且TMC 提供了脑靶向的作用,可使CUR 分布于脑组织中。
此外,李楠等[20]采用微乳法制备了CUR-SLN,其载药量和包封率分别可达7.72%和87.73%。
但放置稳定性实验表明,4 ℃和25 ℃放置1,3 个月后,平均粒径均增大, 且包封率明显下降。
因此,CUR-SLN 虽然可提高CUR 在体生物利用度,但制剂稳定性问题仍是亟待解决的问题。
1.3 聚合物胶束
聚合物胶束是由合成的两亲性嵌段共聚物在水中自组装形成的一种热力学稳定的胶体溶液。聚合物胶束的粒径小且外壳亲水,从而减少了网状内皮系统的吞噬作用,延长了药物体内循环时间,实现了被动靶向。
此外,聚合物载体与特定的配体结合后,可以成功地实现药物的主动靶向,降低毒性,提高生物利用度。
Xu 等[4]利用ε-聚赖氨酸-维生素E 琥珀酸酯(PLL-VES)为载体材料,成功制备了载CUR 聚合物胶束。
经X-射线粉末衍射和差示扫描量热法证明,CUR 是以无定形状态存在于载药聚合物胶束中。
在体神经胶质瘤大鼠模型中,相比于生理盐水组和游离CUR 给药组,聚合物胶束组呈现出显著的肿瘤抑制作用,同时提高了大鼠的存活率。
Gou 等[21]采用纳米沉淀法以甲氧基聚乙二醇/聚己内酯为载体制备了CUR 胶束(CUR/MPEG-PCL),所制备的胶束平均粒径和载药量分别为(27.3±1.3)nm 和(12.95±0.15)%。
通过体外释放度试验证明,该聚合物胶束9 d 内释放了54%的CUR,具有良好的缓释性能。
此外,CUR 作为有效的天然抗肿瘤物质,通过下调核转录因子(NF-κB)诱导细胞凋亡或细胞周期停滞, 可增加小分子化疗药物如阿霉素(DOX)、多西他赛(DTX)等的抗肿瘤效果。
Ma 等[22]采用透明质酸-维生素E 琥珀酸酯(HA-VES)为载体材料,共包载DTX 和CUR 形成自组装聚合物胶束。
体外试验结果表明,该聚合物胶束可以形成均匀的球形纳米粒,并且具有高的载药量和稳定性,呈现良好的缓释效果。
在CUR 的加入作用下,DTX 对多药耐药性MCF-7 细胞(MCF-7/Adr)的细胞毒性高于单包载DTX 的聚合物胶束。
此外,采用透明质酸作为聚合物载体,可以利用其CD44受体的主动靶向作用,增加聚合物胶束的细胞摄取。
因此,聚合物胶束作为良好的载体系统,不仅可以单包载CUR 用于癌症治疗,还可以将CUR与其他抗癌药物共包载于同一载体材料中,实现协同治疗作用。
1.4 聚合物纳米粒
聚合物纳米粒是由天然或合成高分子材料制备的粒径在10~1 000 nm 的固态胶体微粒。目前文献中报道的CUR 聚合物纳米粒主要包括聚乳酸(PLGA)纳米粒、白蛋白纳米粒、壳聚糖纳米粒等。
Shaikh 等[23]利用乳化溶剂蒸发法制备了载CURPLGA 纳米粒,平均粒径为264 nm,载药量为15%。
该纳米粒在24 h 时累计释放度达24%,之后20 d 内缓慢释放20%的CUR,呈现双相体外释放特征。
大鼠体内药动学试验表明,载CUR 纳米粒的生物利用度至少提高了9 倍,显著优于未修饰的游离药物。
葡聚糖硫酸酯-壳聚糖是壳聚糖和葡聚糖硫酸酯通过静电相互作用形成的生物相容材料。
Anitha 课题组[24]采用凝聚法成功地制备了平均粒径为200~220 nm、包封率约为74%的葡聚糖硫酸酯-壳聚糖载CUR 纳米粒。
体外释放数据显示,壳聚糖氨基的质子化作用导致聚合物材料的溶胀,该纳米粒在pH 5.0 介质中的释放度显著高于pH 7.0 介质中的释放度。
体外细胞毒性试验数据表明,该制剂对人乳腺癌细胞(MCF-7)、人前列腺癌细胞(PC-3)和人成骨肉瘤细胞(MG 63)均具有抑制作用。
由于CUR 的生物半衰期比较短,而且在中性和碱性环境下容易水解,因此若想要提高CUR 的生物利用度,就必须克服CUR 本身具有的理化性质。
利用纳米粒的结构特点,将CUR 稳定于载体材料中,从而隐藏药物本身的性质,可以有效地增加CUR 在碱性环境中的稳定性,提高CUR 的体内生物利用度。
此外对纳米粒表面进行修饰得到功能化纳米粒,利用肿瘤微环境的特点,靶向给药控制药物在靶点的持续缓慢释放,这样有效地延长药物的作用时间。
1.5 纳米混悬剂
纳米混悬剂是药物借助少量表面活性剂或者高分子材料的稳定作用形成的多分散体系。
纳米混悬剂既可以作为最终产品,也可以作为一种中间体,进一步加工成口服制剂或者注射剂。
此外,纳米混悬剂由于其粒径小、载药量高,可显著提高药物的溶解度、增加溶出速率、提高生物利用度。
Aditya 等[25]采用反溶剂沉淀法制备了无定形CUR 纳米混悬剂。
课题组选择以β-乳球蛋白为稳定剂,其制备的纳米混悬剂粒径为150~175 nm。
由于CUR 呈无定形态和纳米混悬剂的小粒径,导致CUR 的溶解度增加了35 倍。
Caco-2 细胞体外研究表明,纳米混悬剂显著提高了药物的生物利用度。
Wang 等[26]分别选用TPGS、聚氧乙烯硬脂酸酯(Brij 78)和泊洛沙姆F 68 为稳定剂,采用二氧化碳辅助非晶原位晶化法制备了3 种CUR 纳米混悬剂(CUR-TPGS,CUR-Brij 78,CUR-F 68)。
体外溶出试验显示,TPGS 和Brij 78 作为稳定剂时提供了良好的增溶作用。
大鼠口服给药后体内药动学试验表明,相比于游离CUR 混悬液,3 种纳米混悬剂单剂量给药AUC 分别提高3.18,3.70 和1.25 倍。
CUR 纳米混悬剂不仅增加了CUR 的溶解度,还解决了CUR 稳定性差和体内代谢快带来的制剂困难。
需要注意的是,注射用纳米混悬剂的物理稳定性问题,如颗粒沉降、聚集、长大和晶型改变等,会影响药物的安全性和有效性。
因此,需要选择合适的制备方法和稳定剂保证CUR 纳米混悬剂的疗效。
1.6 聚合物-药物偶联物
聚合物-药物偶联物是药物修饰的主要策略之一,通过这种方式可以增加药物的溶解度、渗透性和稳定性,同时也可能改变药物的生物分布,从而改善其药动学和药效学。
CUR 分子结构中的2 个苯酚环以及活性亚甲基是其结构改造的潜在位点[27-28]。
将CUR 与小分子物质或者亲水性聚合物形成共轭物,可显著提高其溶解度,增加其生物学活性。
其中氨基酸是用来提高CUR 溶解度的主要小分子物质[29],例如脯氨酸、甘氨酸、亮氨酸、丙氨酸、缬氨酸、丝氨酸、半胱氨酸等。
这些氨基酸与CUR 在活化剂的作用下合成的共轭物可以将CUR 的溶解度增加到1~10 mg·mL-1[30] (游离CUR 在pH 5 时的溶解度为11 ng·mL-1[31])。
Nagahama 等[32]采用葡聚糖与CUR 连接形成两亲性共轭物,其在水中可以自组装形成纳米粒。
该纳米粒的粒径约为32 nm,同时水溶性与游离CUR相比提高24 倍。
细胞摄取实验显示,该纳米粒在Hela 细胞中呈现出更高的摄取量。
Tang 等[33]通过β-硫酯键将CUR 与2 个短链聚乙二醇连接起来,合成了Curc-OEG 偶联物。
该偶联物在水溶液中可以自组装形成纳米粒,载药量高达25.3%。
体外释放度试验表明,该纳米粒在高浓度谷胱甘肽(GSH)和酯酶条件下,可以快速释放活性药物CUR。
Curc-OEG 对多种肿瘤细胞系均具有较强的抑制作用。
在人卵巢癌细胞(SKOV-3) 和乳腺癌(MDA-MB-468)异种移植肿瘤动物模型中,静脉注射Curc-OEG 后显著减小肿瘤体积。
初步毒性研究发现,高剂量Curc-OEG 对小鼠内脏器官并未造成急性和亚慢性毒性。
作为药物载体,Curc-OEG 纳米颗粒可以携带其他抗肿瘤药物,如DOX、喜树碱、顺铂等,大大提高化疗药物的细胞毒性。
因此,聚合物-药物偶联物是一个有前途的前药模型,除了可以采用亲水性材料增加难溶性药物的水溶性外,还可选择合适的交联剂,根据肿瘤微环境特点更好地调节药物释放速率,值得进一步研究。
2
CUR 纳米制剂的体外细胞学研究
据文献报道,在体外细胞学研究中,CUR 对多种肿瘤细胞均具有良好的抑制作用,其可通过诱导肿瘤细胞凋亡、调控肿瘤细胞的生长信号传导通路、抑制肿瘤血管生成及增加肿瘤细胞对化疗的敏感性等起到抗肿瘤作用。
Yallapu[34]课题组研究结果表明,载CUR 的聚乳酸纳米粒(Nano-CUR6)在转移性乳腺癌细胞(MDA-MB-231)和顺铂耐药卵巢癌细胞(A2780CP)的摄取量均显著高于游离CUR。
产生上述实验结果的原因可能是由于CUR 在纳米粒中呈现缓释趋势,并且纳米粒增加了药物的内吞作用。
体外细胞毒性试验结果表明,在A2780CP 和MDA-MB-231 肿瘤细胞中,Nano-CUR6 的IC50 分别为13.9,9.1 μmol·L-1,细胞毒性均优于游离CUR(游离CUR的IC50 值分别为15.2,16.4 μmol·L-1)。
为了进一步增加药物的摄取和细胞毒性,Thangavel 等[35]利用肿瘤微环境的酸性和高还原性特点,制备了载CUR 的pH 敏感型氧化还原性纳米胶束(curcumin-loaded pH-sensitive redox nanoparticles,Curcumin@RNPN),并考察了其对PC-3 细胞的促凋亡作用。
相比于游离CUR,Curcumin@RNPN处理后的PC-3 细胞中的活性氧(ROS)水平显著降低,线粒体的损害程度增加。
蛋白免疫印迹检测分析结果显示,Curcumin@RNPN 显著抑制NF-κB的表达,从而诱导细胞凋亡,明显增加早期和晚期凋亡细胞的数量。
对凋亡相关分子如神经酰胺、半胱天冬酶、凋亡诱导因子和酸性神经酰胺酶的评价表明,与游离CUR 相比,Curcumin@RNPN诱导细胞凋亡能力更强。
虽然大多数的CUR 纳米制剂可以有效地提高CUR 的细胞摄取和细胞毒性,但并不是所有的纳米制剂都比游离CUR 效果明显。
Liu 等[36]研究发现包载CUR 的壳聚糖/聚己内酯纳米粒在人宫颈癌细胞Hela 细胞和人脉络膜黑色素瘤细胞OCM-1 细胞中的细胞毒性与游离CUR 无显著性差异。
同时,Anuchapreeda 等[37]课题组制备的CUR 纳米乳在B16F10 小鼠黑色素瘤和白血病细胞系(K562、Molt4、U937 和HL60)的细胞毒性研究也得出了类似的实验结果。
在B16F10 小鼠黑色素瘤和白血病细胞系中,游离CUR 的IC50 值均低于CUR 纳米乳,可能是由于纳米乳的不完全释放引起。
虽然,体外细胞学研究是一种有效的手段对纳米制剂的细胞摄取和细胞凋亡进行研究。
然而,体外细胞学研究实验是将肿瘤细胞长时间暴露在静态浓度的CUR 溶液中(游离CUR 或者CUR 纳米制剂),并不能完全代表体内CUR 的真实浓度变化水平。
因此,细胞学实验往往难以解释结果的相关性,仍需进行体内动物模型和临床试验研究。
3
CUR 纳米制剂的体内研究:体内药动学和药效学
为了更加深入地了解CUR 纳米制剂在肿瘤治疗研究中的作用,药学工作者采用了不同的动物模型对CUR 纳米制剂的体内药动学、生物分布和药效学进行了研究。
Sun 等[38]研究了CUR-聚氰基丙烯酸丁酯纳米粒(CUR-PBCN)和游离CUR 溶液在小鼠体内的药动学和脑分布情况。
单剂量尾静脉分别注射5 mg·kL-1 CUR-PBCN和10 mg·kg-1游离CUR溶液后,相比于游离CUR 溶液,CUR-PBCN 使得CUR的AUC、平均滞留时间(MRT)、分布和消除半衰期分布显著性提高了2.1,14.1,489.1 和37.5 倍。
脑内分布试验显示,由于纳米粒表面的吐温80 作为一种潜在的用于大脑靶向的“前导物质”,可以促进CUR-PBCN 在血脑屏障上进行受体介导的内吞作用,从而有效地增加CUR-PBCN 穿过血脑屏障,使得药物的脑内分布提高3.53 倍。
Chen 等[39]采用PEG 化的壳聚糖-缩酮成功地制备了长循环pH 敏感性CUR 纳米胶束。
小鼠尾静脉注射给药后,溶液在血液中快速消除,给药6 h 后已无法检测到药物的血药浓度。然而,CUR 纳米胶束呈现出缓慢的分布和消除特征,给药后24 h 仍可以检测到血药浓度。
同时,纳米胶束使得药物的体内AUC 提高了2 倍。
作者成功地利用了PEG 长链的“隐藏作用”,避免了药物在血液循环过程中被吞噬细胞消除,从而增加到达靶部位的药物浓度。
同时,在肿瘤微环境低pH 条件下,纳米胶束结构中的缩酮结构发生水解,促进了药物的快速释放,增加了疗效。
因此,可以通过对制备纳米材料表面进行修饰,利用肿瘤环境特点和纳米制剂的靶向作用延长CUR 的体内循环时间、减缓CUR 的体内消除速率、提高生物利用度,从而达到很好的治疗效果。
从以上研究结果可以看出,CUR 纳米制剂很好地改善了CUR 的体内药动学行为,增加了其生物利用度。
然而,纳米制剂给药后的实际治疗效果,仍需通过药效学研究进行评价。
许多研究结果表明,CUR 纳米制剂对多种类型的癌症动物模型具有良好的治疗作用。
Li 等[40] 采用薄膜分散法制备了粒径为18~28 nm CUR 的普朗尼克F-127 聚合物胶束,并对其在S-65 荷瘤小鼠模型中的药效学进行了评价。
实验结果发现,腹腔注射给药17 d 后,纳米胶束给药组的肿瘤体积[(163.55±36.23)mm3]显著低于CUR 混悬液组[ (276.45±58.45)mm3],表明了CUR 纳米胶束可以有效地抑制肿瘤生长。
课题组之后对离体肿瘤组织进行免疫组化染色分析,显示纳米胶束组可以增加肿瘤细胞的凋亡,同时减少了肿瘤组织中血管内皮生长因子的表达。
因此纳米胶束是一种有效的手段,增加类似于CUR 类的抗癌药物的治疗效果。
Wang 等[41]采用A549 荷瘤小鼠为动物模型,分别采用口服和腹腔注射2种方式给予CUR-SLN 和混悬液,组织分布分析表明,SLN 组无论以哪种方式给药,荷瘤小鼠的肿瘤和肺部均检测到高水平的药物浓度。
但是,当CUR 混悬液口服给药后,肿瘤组织未检测到药物浓度。
采用腹腔注射给药时,SLN 在肿瘤和肺部的组织分布量分别是混悬液的4.3 倍和32.6 倍。
所以可以利用SLN 的制剂学优点增加靶组织中药物水平,例如肺部和肿瘤组织。此外,采用生物可降解材料制备SLN,可增加制剂的安全性。
综上所述,与游离药物相比,CUR 纳米制剂可以利用其特定的优势:
小粒径、高比表面积、靶向性、透过机体屏障等一系列特点,并有效地结合肿瘤组织的高渗性、高还原性和低pH 值环境,提高药物的生物利用度,增加治疗效果。
4
结论与展望
大量的研究结果证明,CUR 及其相关衍生物具有良好的抗肿瘤作用,其不仅可以抑制肿瘤的增殖,更体现在抑制肿瘤的发生发展、侵袭转移,从而起到抗肿瘤作用。
近年来,CUR 抗肿瘤纳米制剂的研究在很大程度上改善了CUR 原料药的缺点,在细胞和动物水平上增加了CUR 的治疗效果,为下一步的临床研究和CUR 临床应用奠定基础。
虽然纳米制剂可以在很大程度上解决CUR 治疗效果的问题,但仍存在一些问题需要解决:
①大多数纳米制剂是由合成聚合物制成的,虽然在肿瘤细胞和荷瘤动物模型水平呈现出良好的疗效,但可能对人体正常细胞造成破坏。因此仍需要进行人体临床试验来评估CUR 纳米复合物的药理学和毒理学效果。
②有些制剂虽然在一定程度上提高了CUR 的生物利用度,但可能仍达不到其治疗时体内的最低有效血药浓度,需要选择合适的载体材料对CUR 纳米制剂的载药量和释放度等进行优化调节。
③目前大多数纳米制剂的制备工艺比较复杂,难以投入真正的生产中,因此大规模生产工艺和技术、载药系统的稳定性和质量控制尚待取得突破性进展。
此外,据文献报道,CUR 可以下调P-糖蛋白(P-gp)、多药耐药相关蛋白(MRP-1)等逆转肿瘤细胞的多药耐药性。
因此,纳米制剂可以借助CUR的抗多药耐药性将CUR 与其他抗肿瘤药物(DOX、紫杉醇等)联合应用,提高抗肿瘤治疗效果,这将是一个具有潜力的研究方向。

