据新药前沿初步统计,在过去的3年(2017-2019年),跨国药企的38款原研药物在中国屡屡遭遇本土企业提出的专利权无效请求,国家知识产权局专利局复审和无效审理部(原专利复审委员会)经审理后已作出审查决定有60件,其中全部无效33件(占55%),部分无效20件(占33%),维持有效7件(占12%)
近年来,随着我国药品注册制度的改革和对中国市场重视的加强,跨国制药企业正在加快进口药上市步伐。与此同时,国内制药企业对仿制药立项和开发的需求竞争日益激烈,再加上对于知识产权保护的重视程度越来越高,许多制药公司都设立了独立的知识产权部,而且其知识产权业务也逐渐从专利检索等普通业务向通过寻找专利漏洞立项,主动出击对原研药物进行专利挑战等增值业务转变。
据新药前沿初步统计,在过去的3年(2017-2019年),跨国药企的原研药物在中国屡屡遭遇本土企业提出的专利权无效请求挑战,国家知识产权局专利局复审和无效审理部(原专利复审委员会)经审理后已作出审查决定有60件,其中全部无效33件(占55%),部分无效20件(占33%),维持有效7件(占12%)(见图1和2)。
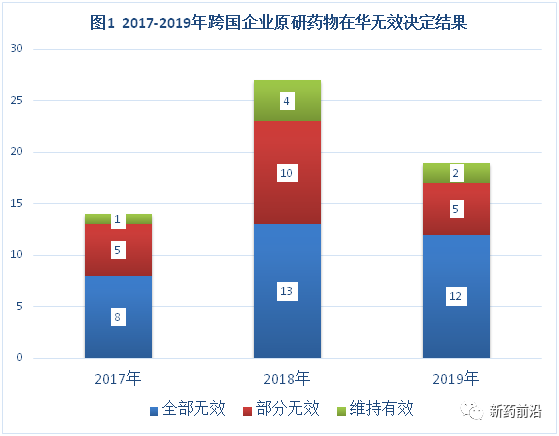
在60件已作出审查决定中,涉及到38款药物(阿格列汀,恩格列净,维格列汀,西格列汀,利格列汀,替格列汀,曲格列汀,利伐沙班,替格瑞洛,阿立哌唑,阿莫西林,艾普拉唑,奥美沙坦酯,苯卓昔芬,布瓦西坦,恩曲他滨/替诺福韦富马酸盐,恩扎卢胺,伐尼克兰,克唑替尼,雷米马唑仑,富马酸丙酚替诺福韦,卢帕他定,鲁比前列酮,沙库巴曲缬沙坦钠,索非布韦,索非那新,索拉非尼,他达拉非,托比司他,托法替布,维帕他韦,沃替西汀,依非韦伦,依托考昔,蔗糖铁,紫杉醇,利妥昔单抗,Teprotumumab)的53件专利。
不具备创造性(专利法第二十二条第3款)无疑是无效请求者最常用法律依据的条款,56件无效请求决定都应用到该条款。
2017-2019年跨国药企药物
专利无效信息
对于原研药物专利无效,一直是业内关注的焦点,下面简单介绍下述4款比较受关注药物的无效请求。
恩扎卢胺
(ZL 200680025545.1)
安斯泰来目前正在申请恩扎卢胺软胶囊进口注册中,于2019年12月获得国家药品监督管理局药品审评中心(CDE)受理。目前暂无国内企业按照新注册分类进行审。
美国加利福尼亚大学于2005年5月13日申请了恩杂鲁胺的化合物专利WO2006124118,对其制备方法及其用途(治疗前列腺癌)进行了保护;目前恩杂鲁胺已在美国、欧洲和中国等多个国家和地区申请了专利保(US2007254933、EP2397469、CN200680025545.1)
麦迪韦逊公司及其全资子公司麦迪韦逊前列腺治疗学公司与专利权人加州大学董事会签署了《独占许可协议》,麦迪韦逊公司及其全资子公司麦迪韦逊前列腺治疗学公司与安斯泰来株式会社签署了《合作协议》。
曾经参与该药物开发并于2015年获得临床批件的2家公司南京海纳医药科技股份有限公司和上海复星星泰医药科技有限公司提出对该专利的无效请求。
南京海纳医药科技股份有限公司于2018年03月09日向专利复审委员会提出了无效宣告请求,其理由是权利要求得不到说明书的支持和不清楚。后经专利权人对相关权利要求书修改,原专利复审委员会于2018年09月28日作出维持有效(决定号37390)。
上海复星星泰医药科技有限公司于2017年12月18日向专利复审委员会提出了无效宣告请求,其理由是不具备创造性,原专利复审委员会审查后于2018年10月25日作出全部无效(决定号37674)的审查决定。
魏昭以个人名义于2018年04月02日以不具备创造性提出的无效请求,原专利复审委员会于2018年12月27日再次作出全部无效的审查决定(决定号38507)。
有意思的是,正大天晴药业集团股份有限公司亦曾经参与该药物开发并于2015年获得临床批件。不过,安斯泰来制药株式会社与麦迪韦逊医疗公司(原告)曾经向江苏省南京市中级人民法院诉正大天晴药业集团股份有限公司、连云港润众制药有限公司(被告)侵害发明专利200680025545.1权,于2017年3月14日立案(案号:(2017)苏01民初529号),法院经一审审理后于2018年5月22日,驳回原告安斯泰来制药株式会社、麦迪韦逊医疗公司的诉讼请求。
替格瑞洛
(ZL 01810564.5/ZL 099815926.3/ZL 200610002509.5)
替格瑞洛是阿斯利康开发的重磅抗凝血药物。
阿斯利康在中国获得了若干保护替格瑞洛的专利,其中最重要有保护化合物结构的专利ZL 99815926.3(2019年12月2日到期)和晶型II专利ZL 200610002509.5(2021年5月31日到期)及制备中间体嘧啶化合物方法的专利ZL 01810564.5(2021年5月31日到期)。
2017年-2018年,深圳信立泰药业股份有限公司相续对上述专利发起无效挑战,3件专利经原专利复审委员会审查后皆作出全部无效的审查决定(决定号分别为:33591,33975,34725)。
看似轻松的专利无效挑战,其实在其后经历了旷日日久的法院诉讼。
2018年1月,阿斯利康正式向北京知识产权法院提起诉讼,请求撤销原专利复审委员会33591号专利无效审查决定,并请求判令其重新作出审查决定。2018年7月,北京知识产权法院认为,本专利权利要求1相对于证据1和公知常识的结合,不具有突出的实质性特点和显著进步,因此不具备创造性,判决驳回阿斯利康公司的诉讼请求。2018年8月,阿斯利康向北京高院提起上诉。2018年12月,北京高院作出二审判决,认为原审判决及被诉决定部分事实认定不清,适用法律错误,依法均应当予以撤销,专利复审委应就该专利的无效宣告请求重新作出审查决定。
此外,阿斯利康公司针对决定号为33975的审查决定已上诉至中华人民共和国最高人民法院(案号:(2019)最高法知行终33号)
托法替布
(ZL 00816941.1/02823587.8)
托法替布是由辉瑞开发的治疗类风湿性关节炎JAK抑制剂。
作为枸橼酸托法替布片仿制药开发速度最快的2家公司,正大天晴药业和齐鲁制药同样提前为其产品批准后能够正常销售扫清专利障碍。
正大天晴药业和齐鲁制药在2018年-2019年对托法替布化合物和晶型专利提出无效请求,原专利复审委员会分别于2018年8月以说明书公开不充分为由对托法替布关键的化合物专利(专利号为ZL 00816941.1、发明名称为“吡咯并[2,3-d]嘧啶化合物”)和2019年11月以权利要求的技术方案不具备创造性为由对其晶型专利(ZL 02823587.8、发明名称为“新型结晶化合物”)的发明专利都作出全部无效决定,决定号分别为36902和42263,且2件无效请求都由正大天晴药业提出(后1件由齐鲁制药和正大天晴药业作为联合无效宣告请求人提出)。
托法替布核心专利在国内被无效,为国内企业对托法替布仿制药上市销售进一步扫清了障碍。正大天晴药业于2019年9月获得该产品的首仿上市,齐鲁制药紧随其后于2019年10月获得该产品第二家仿制药批文。
沙库巴曲缬沙坦钠
(ZL 201110029600.7)
诺华公司开发的诺欣妥(沙库巴曲缬沙坦钠片)是心衰重磅炸弹产品。
2003年1月16日,诺华股份有限公司就向国家知识产权局提交了“含有缬沙坦和NEP抑制剂的药物组合物”(ZL 201110029600.7)专利的申请,2011年6月15日公开,2011年8月10日进入实质审查,并于2013年11月6日获得授权。2017年被以个人名义(戴锦良)提出对专利无效请求,原专利复审委员会成立五人合议组对其进行了公开审理,并于2018年1月3日作出第34432号无效宣告请求决定,宣告专利权全部无效。该案件还被国家知识产权局专利局评为2017年度专利复审无效十大案件之一。
2006年11月8日,诺瓦提斯公司(诺华公司原名称)向国家知识产权局提交了“血管紧张素受体拮抗剂和NEP抑制剂的药物组合产品(ZL 200680001733.0)”专利的申请,2008年1月2日公开,2008年12月24日进入实质审查,并于2013年12月25日获得授权。此后,诺华根据ZL 200680001733.0专利提出分案申请(ZL 201210191052.2)并获得授权。目前,这2件专利在2019年被国内正大天晴、齐鲁制药等多家企业提出专利无效请求并进行了口审,目前尚未公布最终的审查决定。




